PAPILOXYL AHCC®


PAPILOXYL AHCC® Les principes actifs de l'AHCC sont des ingrédients présents dans de nombreux types de champignons et certains sont dérivés d'alpha et de bêta-glucanes, des polysaccharides connus pour leur action bénéfique sur le système immunitaire.
Ils produisent un effet modulateur sur le système immunitaire, augmentent la concentration des lymphocytes T et B, stimulent l'activité des macrophages, renforçant ainsi les défenses de l'organisme contre l'action des virus, bactéries, parasites ou cellules néoplasiques.
AHCC® a fait l'objet de plus de 200 études cliniques menées principalement au Japon. Des recherches sont actuellement en cours dans plus de 150 centres de recherche et hôpitaux universitaires au Japon et aux États-Unis. Chaque année depuis 1994, plus de 300 médecins et chercheurs se réunissent à Sapporo, au Japon, pour le symposium de l'AHCC Research Association.
Extrait de champignon shiitake.
Supplément breveté par Amino up Japan, fabriqué au Japon à l'aide d'un système de culture liquide exclusif.
Riche en polysaccharides alpha-glucanes facilement absorbables.
PAPILOXYL AHCC® La dose recommandée de Papiloxyl est de 3 à 6 gélules par jour, par voie orale 30 minutes avant les principaux repas.
ATTENTION : Les compléments alimentaires ne doivent pas être utilisés comme substitut d'une alimentation variée et équilibrée et d'un mode de vie sain. Tenir le produit hors de portée des enfants

VER ESTUDIO publicado en Frontiers Dra Judith A. Smith
The University of Texas Health Science Center at Houston
McGovern Medical School
Department of Obstetrics, Gynecology, and Reproductive Sciences
 Estudio clínico
Estudio clínico
Conception : Une étude randomisée, en double aveugle, contrôlée par placebo
Sujet : 41 patients infectés de manière persistante par un HPV à haut risque depuis au moins 2 ans
Groupes : AHCC® + placebo pendant 6 mois chacun (n=22) et placebo pendant 12 mois (n=19)
Dose : AHCC® 3 g/jour
Critères d'évaluation : clairance de l'infection par le VPH, nombre de lymphocytes T
Résultat
Après la prise d'AHCC® pendant 6 mois, environ 60 % des patients infectés par le VPH à haut risque ont montré une résolution de l'infection. La supplémentation en AHCC® a également augmenté le nombre de lymphocytes T, ce qui indique que l'AHCC® peut éliminer le VPH en modulant l'immunité.
Article ESSAI CLINIQUE
Devant. Oncol., 22 juin 2022
Sec Oncologie gynécologique
Volume 12 - 2022 | https://doi.org/10.3389/fonc.2022.881902
Sec Oncologie gynécologique
Volume 12 - 2022 | https://doi.org/10.3389/fonc.2022.881902
Supplémentation AHCC ® pour soutenir la fonction immunitaire afin d'éliminer les infections persistantes à papillomavirus humain
 Judith A Smith1,2* ,
Judith A Smith1,2* ,  Anjali A. Gaikwad 1 ,
Anjali A. Gaikwad 1 , peut mathew1 ,
peut mathew1 ,  Barbara Rech3 ,
Barbara Rech3 , Phare Jonathan P.4 ,
Phare Jonathan P.4 ,  Joseph A. Lucci III 1,2 ,
Joseph A. Lucci III 1,2 ,  Yu Bai 5 ,
Yu Bai 5 , Randall J. Olsen6 et
Randall J. Olsen6 et Theresa T. Byrd1
Theresa T. Byrd1- 1 Département d'obstétrique, de gynécologie et des sciences de la reproduction, UT Health McGovern Medical School, Houston, TX, États-Unis
- 2 Département de pharmacie, UT Heath-Memorial Hermann Cancer Center, Houston, TX, États-Unis
- 3 UT Physicians Women's Center, Houston, TX, États-Unis
- 4 spécialistes en obstétrique et gynécologie, Houston, TX, États-Unis
- 5 Département de pathologie, UT Health McGovern Medical School, Houston, TX, États-Unis
- 6 Département de pathologie moléculaire, Houston Methodist Research Institute, Houston, TX, États-Unis
Objectif : Déterminer l'efficacité, l'innocuité et la durabilité de l'utilisation de la supplémentation en AHCC pendant 6 mois pour soutenir le système immunitaire de l'hôte afin d'éliminer les infections à papillomavirus humain (VPH) à haut risque. Le supplément AHCC est un extrait exclusif et standardisé de mycélium cultivé de lentinula edodes (AHCC ® , Amino Up, Ltd., Sapporo, Japon) qui s'est avéré avoir des avantages modulateurs immunitaires uniques.
Étudier le design:Il s'agissait d'une étude randomisée, en double aveugle et contrôlée par placebo (CTN : NCT02405533) menée auprès de 50 femmes de plus de 30 ans présentant des infections persistantes confirmées par le VPH à haut risque depuis plus de 2 ans. Les patients ont été randomisés pour recevoir un placebo une fois par jour pendant 12 mois (N = 25) ou une supplémentation orale de 3 g d'AHCC une fois par jour à jeun pendant 6 mois, suivis de 6 mois de placebo (N = 25). Tous les 3 mois, les patients ont été évalués avec des tests d'ADN et d'ARN du VPH ainsi qu'un échantillon de sang prélevé pour évaluer un panel de marqueurs immunitaires comprenant l'interféron-alpha, l'interféron-bêta (IFN-β), l'interféron-gamma (IFN-γ) , IgG1, lymphocytes T et taux de cellules tueuses naturelles (NK). À la fin de la période d'études de 12 mois,
Résultats:Cinquante femmes atteintes de VPH à haut risque ont été inscrites et 41 ont terminé l'étude. Quatorze (63,6 %) des 22 patientes du groupe de supplémentation de l'AHCC étaient négatives pour l'ARN HPV/ADN HPV après 6 mois, 64,3 % (9/14) obtenant une réponse durable définie comme étant négatives pour l'ARN HPV/ADN HPV après 6 mois de supplémentation. . Dans le bras placebo, deux (10,5 %) des 19 patients étaient HPV négatifs à 12 mois. Parmi les douze patients du groupe placebo qui ont choisi de poursuivre l'étude sans insu, 50 % (n = 6) étaient négatifs pour l'ARN/ADN du VPH après 6 mois de supplémentation en AHCC. Au moment de l'achèvement de l'étude, il y avait un total de 34 patients (22 en aveugle et 12 non aveugles) qui avaient reçu une supplémentation en AHCC avec un taux de réponse global de 58,8 % qui a éliminé les infections persistantes au VPH. Au moment de l'inscription, le niveau moyen d'IFN-β était de 60,5 ± 37. 6 pg/ml chez les femmes présentant des infections persistantes confirmées à HPV. La suppression de l'IFN-β à moins de 20 pg/ml était corrélée à une augmentation des lymphocytes T et de l'IFN-γ et à une élimination durable des infections à HPV chez les femmes ayant reçu une supplémentation en AHCC.
Conclusion : Les résultats de cette étude de phase II ont démontré que l'AHCC 3 g une fois par jour était efficace pour aider le système immunitaire de l'hôte à éliminer les infections persistantes au VPH et qu'il était bien toléré sans qu'aucun effet secondaire indésirable significatif n'ait été signalé. La durée de la supplémentation en AHCC requise au-delà du premier résultat négatif nécessite une évaluation plus approfondie pour optimiser le succès pour des résultats durables. La suppression du taux d'IFN-β à moins de 20 pg/ml est corrélée à la clairance des infections à HPV et mérite une évaluation plus approfondie en tant qu'outil clinique de surveillance des patients atteints d'infections à HPV.
Enregistrement des essais cliniques : clinicaltrials.gov/ct2/, identifiant NCT02405533
Introduction
Le virus du papillome humain (VPH) est classé comme un virus à ADN double brin non enveloppé qui infecte généralement la couche épithéliale des cellules, y compris les surfaces cutanées et muqueuses, et est associé aux verrues bénignes, au carcinome in situ et aux lésions malignes ( 1 , 2 ). Il existe plus de 100 souches de VPH identifiées chez l'homme, 40 souches de VPH à faible risque (LR-HPV) associées aux verrues/lésions génitales et quinze souches de VPH à haut risque (HR-HPV) associées au cancer. Lorsque les infections HR-HPV persistent dans le temps, les patients ont un risque accru de développer un cancer ( 3). Cependant, il convient de noter que le fait d'avoir une infection persistante au VPH à haut risque ne cause pas le cancer en soi; il s'agit plutôt d'un cofacteur contribuant au risque de développement du cancer lorsqu'il survient en combinaison avec d'autres insultes telles qu'une mauvaise alimentation, le tabagisme, le stress physiologique ou un dysfonctionnement/suppression immunitaire. Aux États-Unis, on estime à 85 890 le nombre de cas de cancer causés par des infections persistantes à haut risque par le VPH, et on estime que 79 millions d'Américains sont aujourd'hui infectés par le VPH ( 4 , 5 ).
Bien que la vaccination contre le VPH soit efficace dans la prévention des infections au VPH, elle présente peu d'avantages pour le traitement des patients déjà infectés par le VPH ( 6). Il existe très peu d'options de traitement efficaces pour éradiquer les infections à VPH à haut risque. L'objectif des modalités de traitement actuelles repose sur une détection précoce avec un dépistage de routine par frottis PAP, puis un traitement par le médecin utilisant la cryothérapie, l'excision chirurgicale, la procédure d'excision électrochirurgicale en boucle (LEEP) ou la conisation au couteau froid. Ces procédures ont un taux de réponse plus élevé de 80% à 100%. Ce traitement local enlève la lésion, mais les patients auront fréquemment des lésions récurrentes. Les autres modalités de traitement utilisées pour le traitement LR-HPV comprennent l'application topique de podophyllotoxine avec un taux allant jusqu'à 40 % de lésions récurrentes ou d'imiquimod avec une récurrence d'environ 15 % ( 7 , 8 ). À ce jour, il n'existe aucun traitement systémique efficace pour les infections à VPH persistantes à haut risque.
L'AHCC est un extrait standardisé breveté de mycélium cultivé de lentinula edodes (AHCC ® , Amino Up, Ltd., Sapporo, Japon) qui a été développé au Japon en 1992 ; le composé est principalement composé de composants α-glucane. Plusieurs études animales et humaines ont rapporté une variété d'effets thérapeutiques, y compris des activités antioxydantes et anticancéreuses et une modulation du système immunitaire pour prévenir les processus infectieux des infections virales et bactériennes ( 9 - 14 ). Dans des études cliniques, l'AHCC a démontré l'avantage de réduire le risque d'infection et d'améliorer les symptômes des infections existantes ( 11 ).
Deux études pilotes ont récemment été menées sur des femmes qui avaient documenté une séropositivité persistante pour le VPH pendant plus de 2 ans, étaient par ailleurs en bonne santé et remplissaient les critères d'éligibilité restants ( 15). Dix femmes ont été inscrites à la première étude pour évaluer l'efficacité de la supplémentation en AHCC de 3 g par voie orale une fois par jour pour soutenir le système immunitaire de l'hôte afin d'éliminer les infections persistantes à haut risque par le VPH. Le régime a été répété tous les mois jusqu'à ce que le patient teste HPV négatif ou jusqu'à ce que 6 mois de traitement actif se soient écoulés. Les patients dont le test était positif après 6 mois de traitement étaient considérés comme un échec thérapeutique. Le dépistage du VPH et le dépistage par panel de marqueurs immunitaires ont été effectués une fois par mois pour surveiller l'élimination des infections persistantes au VPH à haut risque. Il y a eu une réponse encourageante chez 4 patients sur 8 (50 %) avec une éradication confirmée de l'ADN HR-HPV après au moins 3 mois et jusqu'à 6 mois de supplémentation quotidienne en AHCC de 3 g ( 15). Dans la deuxième étude pilote avec une supplémentation en AHCC de 1 g une fois par jour, une réponse similaire a été observée chez 4 patients sur 9 (44 %) avec une disparition confirmée des infections persistantes à haut risque par le VPH après 7 mois de supplémentation (15 ) . Ces résultats de deux études pilotes confirment les résultats précliniques précédents selon lesquels la supplémentation en AHCC a le potentiel d'être efficace pour aider le système immunitaire de l'hôte à éliminer les infections persistantes à haut risque par le VPH et a soutenu la justification de poursuivre avec une évaluation formelle de phase II pour confirmer ces conclusions préliminaires ( 16 ).
Matériels et méthodes
Étudier le design
Il s'agissait d'une étude de phase II randomisée, en double aveugle et contrôlée par placebo avec AHCC post-étude sans insu ( Figure 1 ) qui a été examinée et approuvée par le comité d'examen institutionnel du Centre des sciences de la santé de l'Université du Texas HSC-MS14-0866/ NCT02405533. L'étude a été menée chez des femmes de plus de 30 ans présentant des infections à VPH persistantes à haut risque documentées depuis plus de 2 ans ou plus, avaient des valeurs de laboratoire toutes dans les limites normales, avaient une histologie normale jusqu'à la néoplasie intra-épithéliale cervicale 2 (CIN2) tel que documenté par les dossiers du gynécologue principal et jugé par ailleurs en bonne santé. Des informations démographiques sur les patients ont été recueillies, notamment le nombre de partenaires sexuels à vie, les méthodes de contraception et les tests de grossesse périodiques tout au long de l'étude. L'AHCC et le placebo correspondant ont été généreusement fournis par Amino Up, Ltd. (Sapporo, Japon).
Figure 1
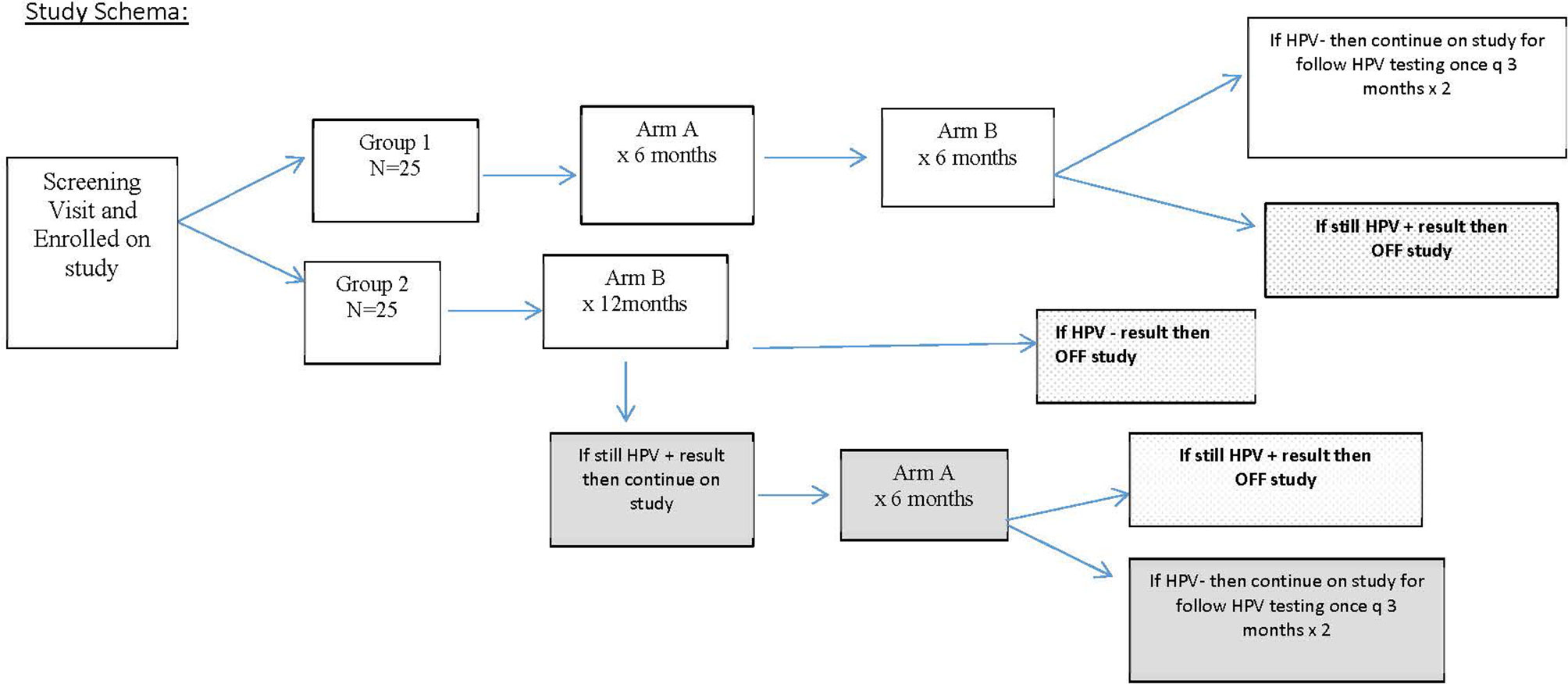
FIGURE 1 Plan d'étude pour le recrutement des patients. Ce schéma explique comment les patients ont été randomisés et l'étendue du suivi basé sur la réponse au papillomavirus humain (HPV) à 12 mois.
Une fois l'éligibilité confirmée sur la base des critères du tableau 1 , les patients ont fourni un consentement éclairé signé et ont été randomisés de manière équitable via une plate-forme informatique entre les deux groupes d'étude, de sorte qu'après l'inscription de 30 patients, il y avait 15 patients dans chaque bras, et à la fin de l'étude. l'inscription à l'étude, il y avait 25 patients dans chaque bras. Le groupe 1 a servi de bras d'intervention et a reçu une supplémentation en AHCC de 3 g par voie orale à jeun une fois par jour pendant 6 mois, suivi de 6 mois de placebo par voie orale à jeun. Le but des 6 mois de placebo dans le groupe 1 était d'aider à faciliter le maintien de l'insu pendant les 12 mois de l'étude. Le groupe 2 a servi de groupe témoin et a reçu un placebo par voie orale à jeun pendant 12 mois.
Tableau 1
Les patients ont été suivis une fois tous les 3 mois au cours de l'étude avec une visite à la clinique pour examiner le journal de la pilule afin d'évaluer l'observance, d'évaluer toute toxicité ressentie au cours des 90 jours précédents et de collecter des échantillons de VPH viaécouvillon/brosse cervicale et échantillon de sang périphérique. L'étude a été ouverte à 12 mois pour déterminer le statut HPV et les résultats des marqueurs immunitaires et révéler les affectations des bras de l'étude. Tous les patients qui ont reçu l'AHCC et qui étaient HPV négatifs à 12 mois ont été suivis pendant 6 mois supplémentaires (pour un total de 12 mois de suivi après la fin de la supplémentation en AHCC). À 12 mois, si sous placebo les patients du groupe témoin étaient toujours positifs pour le VPH, les patients se voyaient proposer de continuer l'AHCC sans insu pour obtenir plus d'informations sur sa toxicité et son efficacité. Le but du "croisement" après la levée de l'aveugle était également d'aider à améliorer le recrutement et l'inscription puisque l'AHCC est un complément nutritionnel facilement disponible.
Le principal résultat de cet essai était d'évaluer la clairance de l'infection persistante par le VPH à haut risque déterminée par les résultats des tests ADN du VPH négatifs obtenus tout en recevant une supplémentation en AHCC et maintenus pendant 3, 6 et 12 mois après la fin de la supplémentation en AHCC par rapport à la réception placebo. À 12 mois, après avoir reçu une supplémentation en AHCC pendant 6 mois, si les patients étaient toujours positifs pour l'ADN du VPH, cela était considéré comme un échec du traitement ou une absence de réponse (NR), et ils ont quitté l'étude. S'ils étaient négatifs après 6 mois de supplémentation en AHCC et 6 mois de placebo, les patients ont poursuivi l'étude pendant 6 mois supplémentaires (deux visites) pour confirmer qu'ils restaient négatifs pour le VPH et pour évaluer la durabilité de la réponse. Une réponse complète (RC) a été définie comme les patients qui étaient négatifs pour l'ARN HPV et l'ADN HPV au moment de la fin de la supplémentation en AHCC et qui sont restés négatifs pour l'ARN HPV et l'ADN HPV tout au long des 12 mois de suivi de la supplémentation en AHCC. Une réponse partielle (RP) a été définie comme les patients qui étaient négatifs pour l'ARN du VPH et l'ADN du VPH au moment de la fin de la supplémentation en AHCC, mais qui ont ensuite été testés positifs pour l'ARN du VPH ou l'ADN du VPH lors d'une ou plusieurs visites au cours des 12 mois de suivi. hors supplémentation en AHCC. Le groupe 2 a servi de témoin pour tous les points temporels pendant la durée de l'étude. Les données d'innocuité et d'efficacité ont été recueillies chez les patients qui ont choisi de continuer la supplémentation en AHCC sans insu pendant 6 mois. Une réponse partielle (RP) a été définie comme les patients qui étaient négatifs pour l'ARN du VPH et l'ADN du VPH au moment de la fin de la supplémentation en AHCC, mais qui ont ensuite été testés positifs pour l'ARN du VPH ou l'ADN du VPH lors d'une ou plusieurs visites au cours des 12 mois de suivi. hors supplémentation en AHCC. Le groupe 2 a servi de témoin pour tous les points temporels pendant la durée de l'étude. Les données d'innocuité et d'efficacité ont été recueillies chez les patients qui ont choisi de continuer la supplémentation en AHCC sans insu pendant 6 mois. Une réponse partielle (RP) a été définie comme les patients qui étaient négatifs pour l'ARN du VPH et l'ADN du VPH au moment de la fin de la supplémentation en AHCC, mais qui ont ensuite été testés positifs pour l'ARN du VPH ou l'ADN du VPH lors d'une ou plusieurs visites au cours des 12 mois de suivi. hors supplémentation en AHCC. Le groupe 2 a servi de témoin pour tous les points temporels pendant la durée de l'étude. Les données d'innocuité et d'efficacité ont été recueillies chez les patients qui ont choisi de continuer la supplémentation en AHCC sans insu pendant 6 mois.
Prélèvement et traitement des échantillons
À chaque visite, un échantillon gynécologique (paroi cervicale ou vaginale) a été prélevé par trois méthodes - brosse de cytologie, balai de cytologie et spatule cervicale - pour garantir un échantillon adéquat et transféré dans un ThinPrep ®flacon d'échantillons gynécologiques liquides (Hologic, Inc., Marlborough, MA, USA). Douze millilitres de sang total ont été prélevés dans des tubes EDTA (BD Biosciences, San Jose, Californie, États-Unis) de tous les patients à chaque visite. Tous les échantillons de sang ont été centrifugés à 1 500 tr/min pendant 10 min, et les échantillons de plasma ont été séparés et stockés à -80°C dans les 6 h suivant le prélèvement jusqu'à utilisation ultérieure. Les cellules mononucléaires du sang périphérique (PBMC) ont été isolées du sang restant par centrifugation en gradient de densité sur le milieu de séparation des lymphocytes Ficoll (Lonza, Bâle, Suisse) en utilisant le protocole du fabricant. Les PBMC ont été cryoconservés dans un milieu de congélation contenant 90% de sérum bovin fœtal (FBS) et 10% de diméthylsulfoxyde (DMSO) dans de l'azote liquide (-196 ° C) jusqu'à leur utilisation ultérieure. Le FBS a été acheté auprès de GIBCO Invitrogen Co. (Carlsbad, Californie, États-Unis). Le DMSO a été acheté chez Sigma-Aldrich Co.
Analyse d'échantillons de papillomavirus humain
Les échantillons de VPH ont été initialement évalués avec le test d'ARN du VPH E6/E7 (APTIMA, Hologic, Marlborough, MA, États-Unis) au laboratoire de pathologie moléculaire de l'UTHealth McGovern Medical School. Les résultats négatifs à l'ARN du VPH ont été confirmés par le test ADN du VPH COBAS (Roche Molecular Systems, Inc., Branchburg, NJ, États-Unis) au laboratoire de pathologie moléculaire méthodiste pour détecter la présence d'ADN du VPH et exclure les infections latentes au VPH.
Dosages de marqueurs immunitaires et de cellules tueuses naturelles
Des kits ELISA en sandwich prêts à l'emploi pour la détection de l'interféron alpha et bêta humain ont été achetés auprès de R&D Systems (Minneapolis, MN, USA). Les kits ELISA d'interféron gamma humain (IFN-γ) et d'IgG1 ont été achetés auprès d'Affymetrix eBioscience (San Diego, Californie, États-Unis). Des tests ELISA en sandwich pour la détection des IgG1 totales, de l'interféron-alpha, de l'interféron-bêta et de l'interféron-gamma ont été effectués selon le protocole du fabricant. Pour chaque série de déterminations de marqueurs immunitaires, une courbe standard a été construite avec des concentrations connues de ces marqueurs fournis avec les kits. Les concentrations plasmatiques de ces marqueurs immunitaires à chaque instant ont été calculées à partir de graphiques standard et ont été comparées aux concentrations de base.
Cinq anticorps anti-humains de souris ont été utilisés pour l'identification et la quantification des cellules tueuses naturelles humaines (cellules NK) : clone CD56 APC, B159 ; Clone CD3 PerCP-Cy5.5, UCHT1; Clone CD2 PE, RPA 2.10; Clone CD7 FITC, M-T701; et clone CD45 APC-H7, 2D1. Tous les anticorps et solutions de lyse de tri cellulaire activé par fluorescence (FACS) ont été achetés auprès de BD Biosciences (San Jose, Californie, États-Unis). Pour l'analyse par cytométrie en flux des cellules NK humaines, les PBMC cryoconservées à chaque instant ont été délicatement décongelées et centrifugées avec 5 ml d'un milieu complet à 1 500 tr/min pendant 5 min à 4 °C. Les culots cellulaires ont été remis en suspension dans 100 ul de tampon FACS (solution saline tamponnée au phosphate (PBS) avec 5 % de FBS). Pour la coloration des cellules, un ensemble de cellules de chaque échantillon a été incubé avec 5 µl de CD45 APC, et le deuxième ensemble de cellules a été incubé avec 50 µl d'un cocktail de cinq anticorps pendant 15 min dans l'obscurité à température ambiante selon le protocole du fabricant. Après l'incubation, 1 ml de tampon de lyse FACS a été ajouté à tous les tubes et a encore été incubé pendant 5 min dans l'obscurité à température ambiante. Pour arrêter la lyse des cellules, 1 ml de PBS a été ajouté à chaque tube immédiatement après l'incubation. Tous les tubes ont ensuite été centrifugés à 1 500 tr/min pendant 5 min, et les cellules ont été remises en suspension dans 500 µl de tampon FACS et stockées à 4°C.
Les cellules colorées ont été acquises à l'aide de LSR II (BD Biosciences) et le logiciel Diva a été utilisé pour l'analyse. Avec l'utilisation de la diffusion vers l'avant et latérale, la population de lymphocytes a été contrôlée sur la faible diffusion latérale et la population lumineuse CD45 tout en acquérant les 50 000 événements contrôlés. La population de cellules NK a ensuite été identifiée comme des cellules (CD3 négatives, CD 2, CD56C et CD7 positives). Le pourcentage de cellules T et de cellules NK de la porte des lymphocytes a été obtenu pour l'analyse finale.
Analyses statistiques
Dans cette population, les femmes atteintes d'infections persistantes au VPH, l'éradication ou la disparition attendue de l'infection au VPH à elle seule est de zéro à 10 %. Le taux de réussite cible basé sur les données de l'étude pilote était de 50 % à 6 mois après la fin de la supplémentation en AHCC et 12 mois après la fin de la supplémentation. Sur la base de ces proportions, clairance de 10 % en l'absence de supplémentation et clairance de 50 % avec supplémentation, une analyse de puissance a été réalisée à l'aide d'une simulation de données dans Mplus 7.2 via un processus en plusieurs étapes ( 17). On s'attendait à ce que la différence proportionnelle soit observée entre le groupe d'intervention de supplémentation en AHCC 1 et le groupe témoin placebo 2 à la fin des 6 mois post-traitement. À un niveau de confiance de 0,05, un échantillon d'un maximum de 50 patients (N = 25 par groupe) a une puissance de 94,5 % pour obtenir la détection de l'effet de l'intervention à l'étude. Les caractéristiques de base des patients par groupe d'étude ont été comparées à l'aide du test du chi carré pour les variables catégorielles et du test de Student pour les variables continues. Le test de Mann-Whitney a été utilisé pour évaluer les différences de taux de réponse en fonction de la durabilité de la réponse HPV (NR, PR et CR) entre les bras de l'étude qui ont répondu par rapport aux non-répondeurs. L'analyse du test t de Student a été utilisée pour évaluer les différences entre les marqueurs immunitaires entre la supplémentation en AHCC et les interventions placebo. Toutes les analyses ont été réalisées avec le logiciel SPSS (version 24) (IBM, New York, NY, USA). Toutes les valeurs de p étaient bilatérales, les valeurs de p inférieures à 0,05 étant considérées comme significatives.
résultats
Cinquante femmes atteintes de HR-HPV ont été inscrites à cette étude et 41 ont terminé l'étude ( Figure 2 ). Tous les patients avaient une infection HPV à haut risque confirmée depuis plus de 2 ans et ont été confirmés à nouveau au moment de l'inscription. Les patients du bras placebo et de la supplémentation en AHCC étaient similaires en termes d'âge, de race/ethnie, d'indice de masse corporelle (IMC), de nombre de partenaires sexuels antérieurs et de nombre de partenaires actuels pendant l'étude. Les informations démographiques sur les patients sont résumées dans le tableau 2. Quatorze (63,6 %) des 22 patientes du groupe de supplémentation en AHCC étaient négatives pour l'ARN/ADN du VPH après 6 mois. Neuf des 14 (64,3 %) patients étaient toujours HPV négatifs avec les méthodes de dosage de l'ARN HPV et de l'ADN HPV 12 mois après l'arrêt de la supplémentation en AHCC. Deux des 14 (14,3 %) patients étaient positifs pour le VPH avec les méthodes de dosage de l'ARN du VPH et de l'ADN du VPH après l'arrêt de l'AHCC à 12 mois. Huit des 22 (36,3 %) patients du bras AHCC étaient HPV positifs avec les méthodes de dosage de l'ARN HPV et de l'ADN HPV après 6 mois de supplémentation en AHCC. Dans le bras placebo, deux (10,5 %) des 19 patients étaient HPV négatifs à 12 mois. Dix-sept (89,5 %) patients sont restés HPV positifs à la fin des 12 mois. Douze patients ont terminé l'étude sans insu et 50 % (n = 6) étaient négatifs pour l'ARN/ADN du VPH après 6 mois de supplémentation en AHCC. La combinaison des 34 patients qui ont reçu une supplémentation en AHCC donne un taux de réponse global de 58,8 % qui a éliminé les infections persistantes au VPH. Ces résultats sont résumés dansTableau 3 . Tous les patients ont été inclus dans l'analyse d'innocuité pour comparer le profil de toxicité de la supplémentation en AHCC au placebo. Aucun patient n'a signalé de grade supérieur à 1 (Critères de terminologie communs pour les événements indésirables (CTCAE) V5.0, 2018) sous placebo ou avec la supplémentation en AHCC, et les événements indésirables se sont résolus au cours du premier mois de l'étude. Aucun patient n'a interrompu l'étude en raison d'événements indésirables. Le profil de toxicité de la supplémentation en AHCC était comparable à celui du placebo ( tableau 4 ).
Figure 2
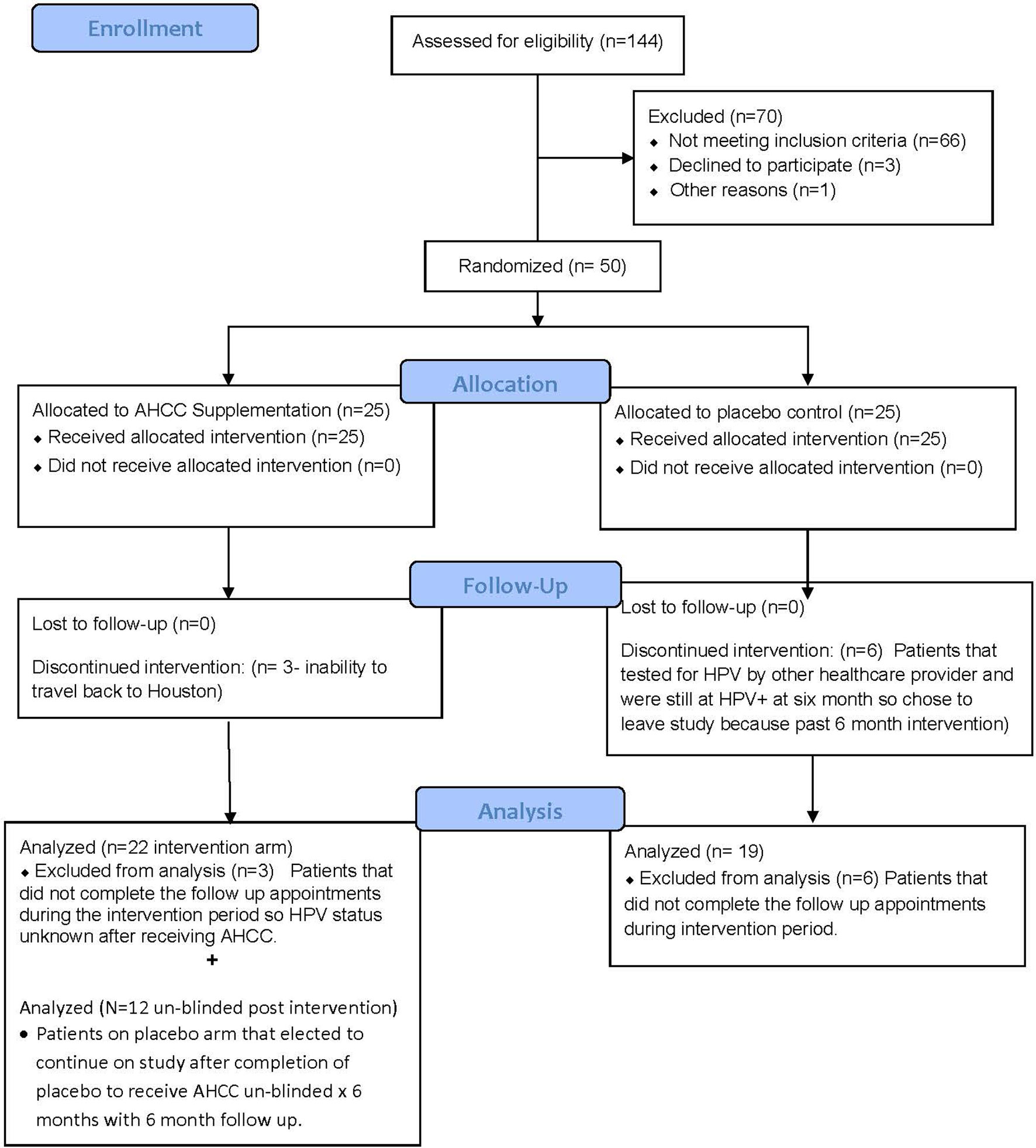
FIGURE 2 Résumé du recrutement et de l'analyse des patients. Ce diagramme CONSORT résume le nombre total de patients inscrits, ayant terminé l'étude et inclus dans l'analyse des données.
Tableau 2
Tableau 3
Tableau 4
Les ELISA et l'analyse en flux des lymphocytes totaux et des cellules NK effectuées sur des échantillons de plasma à différents moments de 41 patients ayant terminé l'étude ont montré que la suppression de l'IFN-β à moins de 20 pg/ml était corrélée à une augmentation des lymphocytes T et de l'IFN-γ et l'élimination des infections au VPH chez les femmes qui ont reçu une supplémentation en AHCC. La variation moyenne en pourcentage des lymphocytes T par rapport au départ se situait entre 25 % et 45 % chez les répondeurs complets, ce qui était statistiquement significatif. Il y avait une augmentation moyenne de 45 % des lymphocytes T à 6 mois chez les répondeurs complets et partiels, tandis que les non-répondeurs et les patients sous placebo n'ont pas montré de changement significatif des lymphocytes T. Le pourcentage moyen de changement dans les cellules NK était inférieur à 10 % par rapport à la ligne de base et n'était pas statistiquement significatif dans tous les groupes. Ces résultats sont résumés dansFigures 3 , 4 .
Figure 3
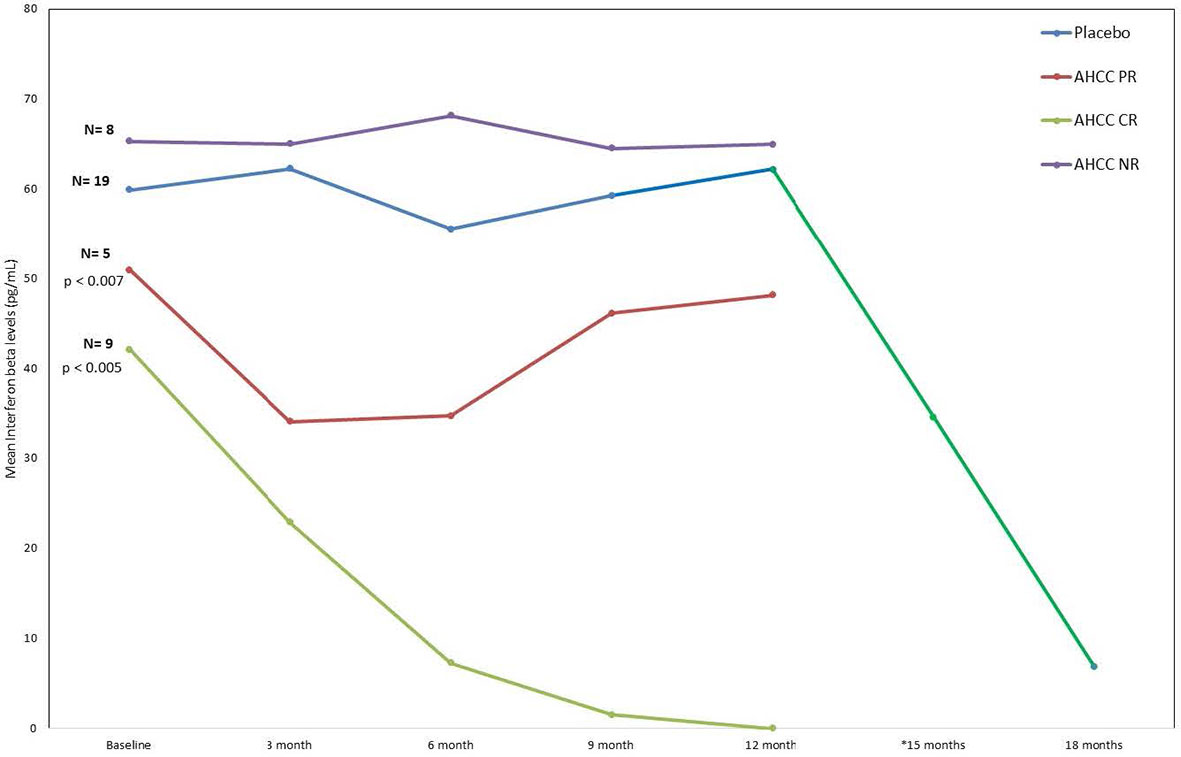
FIGURE 3 Résumé de la réponse à l'interféron bêta (IFN-β) d'un patient de phase II. Ce graphique montre bien comment les niveaux d'IFN-β ont diminué chez les patients qui ont reçu l'AHCC. Si le niveau chute en dessous de 20 pg/ml, il est associé à une élimination durable de l'infection par le virus du papillome humain (VPH). La baisse significative de l'IFN-β (ligne verte) à 12 mois représente les niveaux chez les patients qui ont reçu une supplémentation en AHCC sans insu.
Figure 4
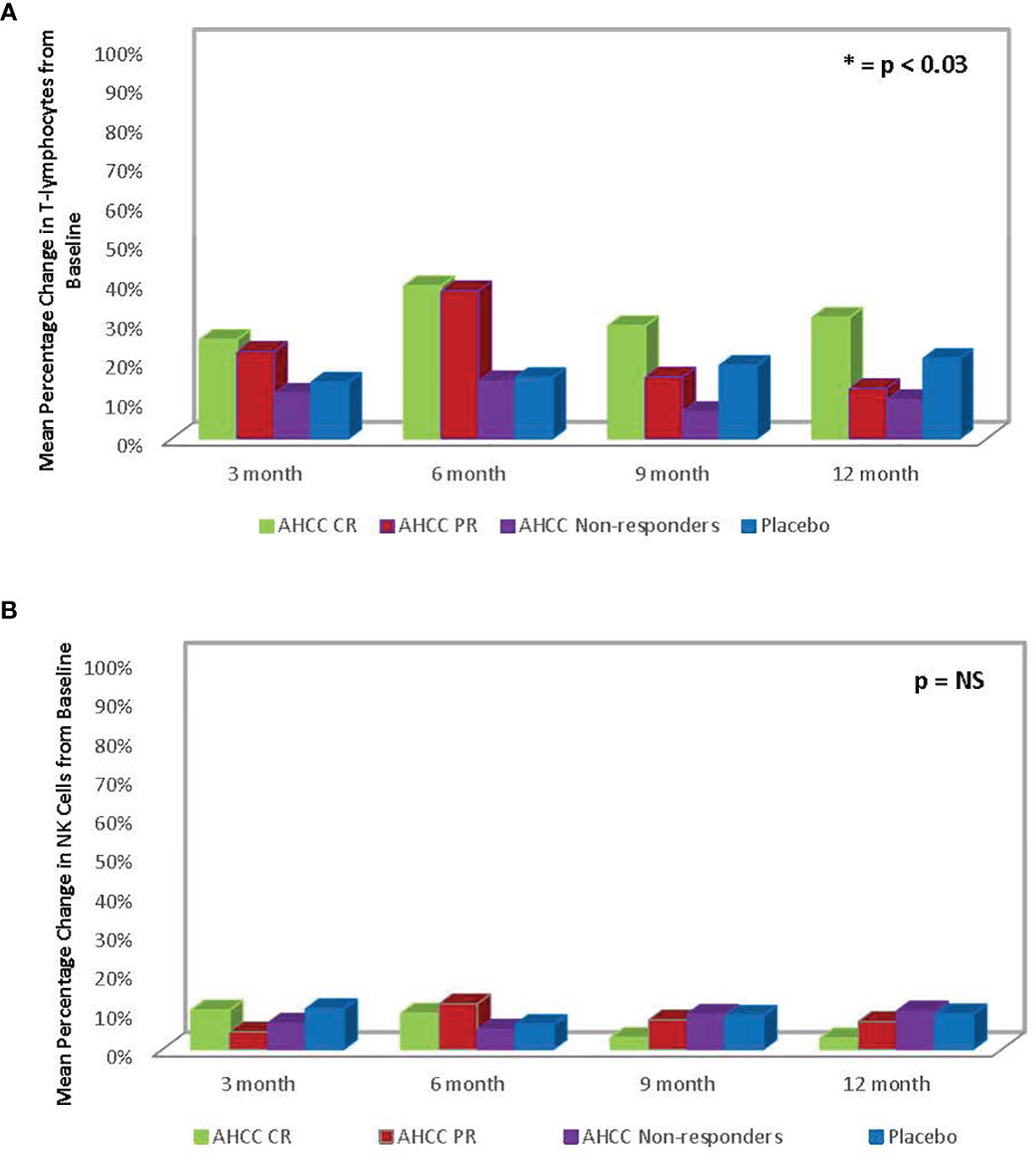
FIGURE 4 (A) Résumé du changement moyen en pourcentage des lymphocytes T par rapport au départ chez les patients en phase II. Le changement dans les lymphocytes T était corrélé à la clairance des infections à papillomavirus humain (HPV). (B) Résumé de la réponse de l'interféron gamma (IFN-γ) du patient de phase II. L'augmentation de l'IFN-γ, un interféron de type II, est corrélée à la diminution de l'IFN-β, un interféron de type I, et finalement à la disparition des infections à HPV.
discussion
Il s'agissait de la première étude clinique en double aveugle, contrôlée par placebo, à démontrer que le supplément nutritionnel, AHCC, est efficace pour éliminer les infections persistantes à haut risque par le VPH avec une réponse durable chez les patients qui ont atteint un niveau d'IFN-β inférieur à 20 pg/ ml. Dans l'ensemble, l'AHCC a été bien toléré et a eu des effets indésirables comparables à ceux du placebo.
Actuellement, il existe peu d'options efficaces pour éliminer les infections persistantes à HR-HPV, et la plupart impliquent des procédures invasives ou des traitements topiques locaux qui n'empêchent pas nécessairement le virus HPV de revenir à cet endroit ou potentiellement dans d'autres zones du corps infectées telles que l'anus. ou épithélium infecté de la tête et du cou. Heureusement, la plupart des patients dont le système immunitaire est sain élimineront par eux-mêmes les infections à VPH à haut risque dans les 6 à 18 mois, sans aucune intervention ( 16 , 18 ). Environ 10% seulement des patients souffrent généralement d'infections persistantes au VPH ( 16 , 18 ). Il n'y a pas d'autres interventions systémiques qui se sont avérées avoir une réponse durable pour éliminer les infections persistantes au VPH.
L'AHCC est un extrait exclusif et standardisé de mycélium cultivé de lentinula edodes (AHCC ® , Amino Up, Ltd., Sapporo, Japon) ; Le composé est principalement composé de composants α-glucane par rapport à la plupart des extraits de champignons, qui sont composés de composants β-glucane. L'AHCC présente une modulation immunitaire unique pour réguler à la baisse le niveau d'IFN-β hyperstimulé, ce qui entraîne une rétroaction négative pour déclencher la libération d'IFN-γ et de lymphocytes T nécessaires pour éliminer les infections virales chroniques ( 17). Cette réinitialisation de l'immunité de l'hôte a été démontrée dans deux études indépendantes par Wilson et ses collègues et Teijaro et ses collègues, qui ont évalué les infections persistantes par le virus de la chorioméningite lymphocytaire (LCMV) et ont démontré que la suppression de la signalisation IFN-β chronique peut réinitialiser l'immunité de l'hôte et permettre le contrôle et l'élimination des infections virales persistantes ( 19 , 20 ). En général, les extraits de champignons β-glucanes sont des stimulants immunitaires de la voie IFN-β, qui sont utiles pour soutenir le système immunitaire dans les infections aiguës, mais pas autant dans les infections virales chroniques. Auparavant, Gao et ses collègues ont démontré les effets immunomodulateurs de l'AHCC dans une étude qui a montré une activation accrue de l'antigène (Ag) des lymphocytes T CD4 (+) et CD8 (+) ainsi qu'une augmentation des cellules NK ( 10). De plus, Roopngam et ses collègues ont démontré que les β-glucanes des polysaccharides du pleurote gris ( Pleurotus sajor-caju ) ont une puissante activité immunomodulatrice ( 21 ). L'immunomodulation d'un polysaccharide de champignon améliore l'expansion des lymphocytes T CD+/CD8+ ( 21 ). Les données de cette étude clinique ont également montré une augmentation significative des lymphocytes T chez les patients qui étaient dans le bras de supplémentation en AHCC.
Le système immunitaire humain commence à s'affaiblir vers l'âge de 25 ans, ce qui pourrait expliquer pourquoi les infections persistantes au VPH sont le plus souvent observées chez les femmes de plus de 30 ans ou souffrant d'autres affections immunosuppressives.
Cette étude de phase II a confirmé les résultats des deux études pilotes précédentes qui ont démontré que la supplémentation en AHCC modulera le système immunitaire de l'hôte pour éliminer les infections persistantes au VPH à haut risque ( 14 ). Bien que cela puisse ne pas aider tous les patients, en l'absence d'autres traitements systémiques, les cliniciens peuvent recommander l'AHCC, qui est un complément nutritionnel facilement disponible qui offre de bonnes chances d'éliminer les infections persistantes au VPH.
Auparavant, les deux études pilotes évaluant la supplémentation en AHCC chez les femmes atteintes d'infections persistantes à HR-HPV avaient identifié que des taux d'IFN-β inférieurs à 20 pg/ml étaient corrélés à l'élimination de HR-HPV ( 17). Cette étude de phase II a confirmé la corrélation entre les niveaux d'IFN-β supprimés à moins de 20 pg/ml avec une augmentation des lymphocytes T et de l'IFN-γ, ce qui a finalement abouti à la disparition des infections au VPH chez les femmes ayant reçu une supplémentation en AHCC. Chez les patients qui étaient négatifs pour l'ARN HPV/ADN HPV après 6 mois de supplémentation en AHCC mais qui avaient un taux moyen d'IFN-β supérieur à 20 pg/ml, deux sont restés négatifs pour l'ARN HPV mais positifs pour l'ADN HPV, et trois étaient à la fois ARN HPV et HPV ADN positif 3 mois plus tard après l'arrêt de la supplémentation. Cela a identifié l'opportunité pour de futures recherches d'optimiser et de personnaliser la durée de la supplémentation à la fois sur le statut d'infection par le VPH et sur le niveau cible d'IFN-β. De plus, les données de cette étude ont identifié l'opportunité potentielle d'employer la surveillance des niveaux d'IFN-β, qui pourrait être utilisé à la fois pour les hommes et les femmes infectés par le VPH. Bien que cette étude se soit concentrée sur les femmes infectées par le HR-HPV, en l'absence d'outils de test efficaces pour le statut HPV chez les hommes et avec un profil d'innocuité comparable au placebo, l'utilisation de la supplémentation en AHCC pour les hommes ayant une exposition connue au HR-HPV (c'est-à-dire , partenaires de femmes atteintes de HR-HPV) ainsi que celles atteintes d'infections à LR-HPV pourraient envisager une supplémentation en AHCC pour éliminer l'infection à HPV.
Cette étude de phase II s'est appuyée sur des études précliniques in vitro , in vivoétudes animales et deux études pilotes qui ont déterminé le mécanisme d'action et confirmé les avantages de la supplémentation en AHCC pour éliminer les infections persistantes au VPH. La plus grande force de cette étude est que même si l'AHCC n'est pas une intervention médicamenteuse traditionnelle, les avantages de la supplémentation en AHCC ont été limités au test d'efficacité traditionnel d'un essai en double aveugle, randomisé et contrôlé par placebo. Contrairement à de nombreuses études sur les suppléments nutritionnels, cette étude a examiné des marqueurs immunitaires spécifiques pour confirmer le mécanisme de modulation de l'AHCC de la fonction immunitaire de l'hôte. En raison de ressources financières limitées, cette étude n'a pas pu explorer tous les mécanismes possibles de modulation immunitaire qui auraient pu favoriser l'élimination des infections persistantes au VPH. Étant donné que l'hypothèse des avantages de l'AHCC est basée sur la modulation de la fonction immunitaire de l'hôte,
En conclusion, les résultats de cette étude de phase II ont démontré que l'AHCC 3 g une fois par jour était efficace pour aider le système immunitaire de l'hôte à éliminer les infections persistantes au VPH et qu'il était bien toléré sans qu'aucun effet secondaire indésirable significatif n'ait été signalé. La durée de la supplémentation en AHCC requise au-delà du premier résultat négatif nécessite une évaluation plus approfondie pour optimiser les résultats durables en fonction à la fois du statut d'infection par le VPH et du niveau cible d'IFN-β.
Déclaration de disponibilité des données
Les contributions originales présentées dans l'étude sont incluses dans l'article/le matériel supplémentaire. Toute autre demande peut être adressée à l'auteur correspondant.
Déclaration d'éthique
Les études impliquant des participants humains ont été examinées et approuvées par le comité d'examen institutionnel du centre des sciences de la santé de l'Université du Texas. Les patients/participants ont fourni leur consentement éclairé écrit pour participer à cette étude. Un consentement éclairé écrit a été obtenu de la ou des personnes pour la publication de toute image ou donnée potentiellement identifiable incluse dans cet article.
Contributions d'auteur
JS a été chercheur principal de l'essai clinique et était responsable du concept de l'étude, de la conception du protocole, de l'analyse des données, de l'interprétation clinique des données, de la rédaction et de la finalisation du manuscrit. AG, LM et BR ont constitué la principale équipe de recherche responsable du dépistage des patients, des visites à la clinique, de la collecte et de l'analyse des échantillons et ont participé à la rédaction et à la révision du manuscrit. JF a servi de collaborateur clinique dans cette étude et a participé à la conception du protocole, à l'interprétation clinique des données et à l'examen final du manuscrit. JL a servi de collaborateur clinique dans cette étude et a participé à l'interprétation clinique des données et à l'examen final du manuscrit. YB a servi de collaborateur de recherche participant à l'interprétation de l'échantillon d'analyse, à la conception du protocole et à l'examen du manuscrit final. RO a servi de collaborateur de recherche en participant à l'interprétation de l'échantillon d'analyse et aux implications pour les futurs tests de surveillance. J'ai participé à la révision et à la finalisation du manuscrit. TB a servi de collaborateur clinique dans cette étude et a participé à la conception du protocole, à l'interprétation clinique des données et à l'examen final du manuscrit. Tous les auteurs répertoriés ont apporté une contribution substantielle, directe et intellectuelle au travail et ont approuvé sa publication. et examen final du manuscrit. Tous les auteurs répertoriés ont apporté une contribution substantielle, directe et intellectuelle au travail et ont approuvé sa publication. et examen final du manuscrit. Tous les auteurs répertoriés ont apporté une contribution substantielle, directe et intellectuelle au travail et ont approuvé sa publication.
financement
Cette étude a été soutenue par le NIH-NCI Small Grants Program for Cancer Research (1R03CA212935), qui n'a pas participé à la conception de l'étude, à la collecte des données, à l'analyse des données et à l'interprétation ou à la rédaction du manuscrit ou de sa publication.
Conflit d'intérêt
JS a reçu diverses subventions de recherche sans restriction soutenant des études précliniques sur l'AHCC avant 2014 d'Amino Up, Ltd.
Les autres auteurs déclarent que la recherche a été menée en l'absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d'intérêts potentiel.
Note de l'éditeur
Toutes les affirmations exprimées dans cet article sont uniquement celles des auteurs et ne représentent pas nécessairement celles de leurs organisations affiliées, ou celles de l'éditeur, des éditeurs et des réviseurs. Tout produit pouvant être évalué dans cet article, ou toute réclamation pouvant être faite par son fabricant, n'est ni garanti ni approuvé par l'éditeur.
Remerciements
Les résultats finaux de l'étude seront présentés sous forme de présentation orale lors de la réunion virtuelle de l'Association centrale d'obstétrique et de gynécologie, le 7 novembre 2020, et sont récipiendaires du prix "Dr. Prix George W. Morley Memorial Paper ».
Les références
1. Harris RWC, Brinton LA, Cowdell RH, Skegg DC, Smith PG, Vessey MP, et al. Caractéristiques des femmes atteintes de dysplasie ou de carcinome in situ du col de l'utérus. Br J Cancer (1980) 42:359–69. doi : 10.1038/bjc.1980.246
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
2. Furumoto H, Irahara M. Virus du papillome humain (VPH) et cancer du col de l'utérus. Le Journal d'Investigation Médicale : JMI. (2002) 49(3-4):124–33.
3. Schiffman M, Wheeler CM, Castle PE. L'ADN du virus du papillome humain reste détectable plus longtemps que les anomalies cytologiques cervicales associées. J Infect Dis (2002) 186:1169–72. doi9 : 10.1128/JCM.42.2.505-511.2004
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
4. À propos du VPH, Centers for Disease Control and Prevention . Disponible sur : https://www.cdc.gov/hpv/parents/about-hpv.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fhpv%2Fparents%2Fwhatishpv.html Consulté le 13/09/19 .
5. Maladies sexuellement transmissibles (MST). Centres de contrôle et de prévention des maladies . Disponible sur : https://www.cdc.gov/std/hpv/default.htm consulté le 17/09/19.
6. Koutsky LA, Ault KA, Wheeler CM, Brown DR, Barr E, Alvarez FB, et al. Un essai contrôlé d'un vaccin contre le papillomavirus humain de type 16. NJMED (2002) 347(21):1645–51. doi : 10.1056/NEJMoa020586
7. Von Krogh G, Heldberg D. Auto-traitement à l'aide d'une crème de podophyllotoxine à 0,5 % de condylomes génitaux externes acuminés chez la femme. Une étude contrôlée par placebo en double aveugle. Sex Transm Dis (1992) 19(3):170–4. doi : 10.1097/00007435-199205000-00012
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
8. Beutner KR, Conant MA, Friedman-Kien AE, Conant MA, Illeman M, Thisted RA, et al. Podofilox appliqué par le patient pour le traitement des verrues génitales. Lancet (1989) 1(8642):831–4. doi : 10.1016/S0140-6736(89)92282-4
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
9. Uno K, Kosuna K, Sun B, Fujii H, Wakame K, Chikumaru S, et al. Le composé actif corrélé à l'hexose (AHCC) améliore les paramètres immunologiques et l'état de performance des patients atteints de tumeurs solides. Biothérapie (2000) 14:303–9. doi : 10.4162/nrp.2015.9.2.129
10. Gao Y, Zhang D, Sun B, Fujii H, Kosuna K, Yin Z. Le composé corrélé à l'hexose actif améliore la surveillance des tumeurs en régulant les réponses immunitaires innées et adaptatives. Cancer Immunol Immunother (2006) 55:1258–66. doi : 10.1007/s00262-005-0111-9
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
11. Miura T, Kitadte K, Nishioka H, Wakame K. Études fondamentales et cliniques sur le composé corrélé à l'hexose actif. Dans : Bagchi D, Lau FC, Ghosh DK, éditeurs. Biotechnologie dans les aliments fonctionnels et les nutraceutiques . Londres, Royaume-Uni : CRC Press Taylor et Francis Group (2010). p. 51–9.
12. Hirose A, Sato E, Fujii H, Suna B, Nishiokaa H, Aruom OI, et al. L'influence du composé corrélé à l'hexose actif (AHCC) sur la chimiothérapie évoquée par le cisplatine et les effets secondaires chez les souris porteuses de tumeurs. Toxicol Appl Pharmacol (2007) 222 : 152–8. doi : 10.1016/j.taap.2007.03.031
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
13. Ishibashi H, Ikeda T, Tansho S, Ono Y, Yamazaki M, Sato A, et al. Efficacité Prophylactique D'une Préparation De Basidiomycètes AHCC Contre Les Infections Opportunistes Mortelles Chez La Souris. Yakugaku Zasshi (2000) 120 : 715–9. doi : 10.1248/yakushi1947.120.8_715
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
14. Hunter RJ, Fujii H, Wakame K, Gaikwad A, Wolf JK, Smith JA. Évaluation du composé actif corrélé à l'hexose (AHCC) en association avec la doxorubicine liposomale pégylée pour le traitement du cancer de l'ovaire. Int J Appl Res Natural Products (2011) 4(3):6–11. Disponible sur : http://www.doaj.org/doaj?func=openurl&issn=19406223&genre=journal
15. Muthen LK, Muthen BO. (1998-2011). Guide de l'utilisateur Mplus . Sixième édition. Los Angeles, Californie : Muthén & Muthén (2014).
16. Ho GYF, Bierman R, Beardsley L, Chang CJ, Burk RD. Histoire naturelle de l'infection à papillomavirus cervico-vaginal chez les jeunes femmes. N Engl J Med (1998) 338(7):423–8. doi : 10.1056/NEJM199802123380703
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
17. Smith JA, Mathew L, Gaikwad A, Rech B, Burney MN, Faro JP, et al. De la paillasse au chevet : évaluation de la supplémentation en AHCC pour moduler l'immunité de l'hôte afin d'éliminer les infections à papillomavirus humain à haut risque. Avant Oncol (2019) 9:173. doi : 10.3389/fonc.2019.00173
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
18. Doorbar J. Host Control of Human Papilloma Virus Infection and Disease. Best Prac Res Clin Obstet Gynecol (2018) 47:27–41. doi : 10.1016/j.bpobgyn.2017.08.001
19. Wilson EB, Yamada DH, Elsaesser H, Herskovitz J, Deng J, Cheng G, et al. Blocage de la signalisation chronique de l'interféron de type I pour contrôler l'infection LCMV persistante. Sciences (2013) 340 : 202–7. doi : 10.1126/science.1235208
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
20. Teijaro JR, Ng C, Lee AM, Sullivan BM, Sheehan KCF, Welch M, et al. L'infection LCMC persistante est contrôlée par le blocage de la signalisation de l'interféron de type I. Sciences (2013) 340 : 207–11. doi : 10.1126/science.1235214
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
21. Roopngam PE, Sralongrua T, HuayKra A. Augmentation de la réponse des lymphocytes T humains par les cellules dendritiques pulsées avec HPV16E7 et Pleurotus Sajor-Caju-β-Glucan (PBG). Iran J Immunol (2018) 15(4):246–55. doi : 10.22034/IJI.2018.39394
Résumé PubMed | Texte intégral de la référence croisée | chercheur google
Mots-clés : AHCC, prévention du cancer, cancer du col de l'utérus, VPH, immunomodulation, interféron-bêta, suppléments nutritionnels
Citation : Smith JA, Gaikwad AA, Mathew L, Rech B, Faro JP, Lucci JA III, Bai Y, Olsen RJ et Byrd TT (2022) AHCC ® Supplementation to Support Immune Function to Clear Persistent Human Papillomavirus Infections. Devant. Oncol. 12:881902. doi : 10.3389/fonc.2022.881902
Reçu : 03 mars 2022 ; Accepté : 25 mai 2022 ;
Publication : 22 juin 2022.
Revu par:
Richard Lee , Case Western Reserve University, États-UnisElena Y. Enioutina , Université de l'Utah, États-Unis
Copyright © 2022 Smith, Gaikwad, Mathew, Rech, Faro, Lucci, Bai, Olsen et Byrd. Il s'agit d'un article en libre accès distribué sous les termes de la licence Creative Commons Attribution (CC BY) . L'utilisation, la distribution ou la reproduction dans d'autres forums est autorisée, à condition que le ou les auteurs originaux et le ou les titulaires des droits d'auteur soient crédités et que la publication originale dans cette revue soit citée, conformément à la pratique académique acceptée. Aucune utilisation, distribution ou reproduction non conforme à ces conditions n'est autorisée.
*Correspondance : Judith A. Smith, [email protected]
Avis de non-responsabilité : toutes les affirmations exprimées dans cet article sont uniquement celles des auteurs et ne représentent pas nécessairement celles de leurs organisations affiliées, ni celles de l'éditeur, des éditeurs et des réviseurs. Tout produit pouvant être évalué dans cet article ou toute réclamation pouvant être faite par son fabricant n'est ni garanti ni approuvé par l'éditeur.

Cumple las declaraciones saludables reconocidas (CE) nª 432/2012 de La Autoridad Europea para la Seguridad de los Alimentos (European Food Safety Authority - EFSA)

Papiloxyl está registrado en la Agencia Española de Consumo, Seguridad Alimentaria y Nutrición (AECOSAN) cumpliendo la normativa vigente.
WARNING: ADVERTENCIA: PAPILOXYL es un complemento alimenticio. Los complementos alimenticios no deben ser utilizados como sustitutos de una dieta variada y equilibrada y un estilo de vida saludable. Mantener el producto fuera del alcance de los niños.


.jpg)